Kardiale Thromboembolie
Die Thromboembolie ist weltweit eine führende Todesursache (1). Embolien mit Ursprung in den Vorhöfen, dem linken Herzohr, den Ventrikeln, den Klappen und der proximalen Aorta können Schlaganfälle, TIAs (transitorische ischämische Attacken), Koronararterienverschlüsse und periphere Embolisationen verursachen. Schlaganfälle sind die dritthäufigste Todesursache in westlichen Ländern. Bei der Mehrheit der Patienten mit Schlaganfall oder TIA werden Ultraschalluntersuchungen durchgeführt. Der Zweck der Durchführung eines Ultraschalls besteht darin, potentielle kardiale Emboliequellen zu finden sowie die Karotiden und Hirnarterien zu beurteilen. Mit dem Ultraschall können atherosklerotische Plaques, Thromben, Okklusionen und Dissektionen dargestellt werden.
Der Schlaganfall wird in den hämorrhagischen Schlaganfall (13% aller Fälle) und den ischämischen Schlaganfall (87% aller Fälle) unterteilt. Die Begriffe hämorrhagischer Schlaganfall und intrazerebrale Blutung werden synonym verwendet. Ein hämorrhagischer Schlaganfall impliziert eine direkte Blutung in das Gehirnparenchym. Die häufigste zugrunde liegende Ätiologie ist die Hypertonie. Ein ischämischer Schlaganfall tritt auf, wenn eine Hirnarterie aufgrund einer lokalen Atherothrombose oder einer Okklusion aufgrund einer Embolisation verschlossen ist. Etwa 30% aller ischämischen Schlaganfälle werden durch kardiale Embolien verursacht. Diese Zahl enthält keine paradoxen Embolien (unten diskutiert) oder Embolien aus der proximalen Aorta.
Schlaganfall und TIA (transitorische ischämische Attacke)
Der ischämische Schlaganfall macht 87% aller Schlaganfälle aus und wird weiter in folgende Kategorien unterteilt:
- Lakunärer Schlaganfall oder lakunärer Hirninfarkt (Okklusion kleiner, das Hirngewebe penetrierender Arterien): Dies ist die häufigste Art von ischämischem Schlaganfall. Beim lakunären Hirninfarkt kommt es zu einer Okklusion kleiner penetrierender Arterien, welche tiefe Hirnstrukturen mit Blut versorgen. Der lakunäre Schlaganfall führt zu fünf klassischen lakunären Syndromen, nämlich:
- (1) Pure motor stroke bzw. Hemiparese
- (2) Ataktische Hemiparese
- (3) Dysarthrie
- (4) Pure sensory stroke
- (5) Mixed sensorimotor stroke
- Kardioembolischer Schlaganfall
- Thromboembolie im Zusammenhang mit zerebraler Atherosklerose
- Kryptogener Schlaganfall: Diese Fälle haben keinen bekannten Mechanismus
- Paradoxe Embolie: Eine paradoxe Embolie tritt auf, wenn thromboembolisches Material vom venösen Kreislauf in den arteriellen Kreislauf transportiert wird, z.B. über ein persistierendes Foramen ovale (PFO), durch welches Blut vom linken in den rechten Vorhof fließt.
Die Echokardiographie ist für den kardioembolischen Schlaganfall, den kryptogenen Schlaganfall und der aus der proximalen Aorta stammenden Embolie von Bedeutung.
Die kardiale Embolie ist die Ursache für 30% aller ischämischen Schlaganfälle.
Embolisches Material
Kardiale Embolien können aus folgenden Materialien bestehen:
- Geronnenes Blut
- Tumorgewebe
- Fragmente von Vegetationen (septische oder aseptische Vegetationen)
- Fragmente von Verkalkungen
- Atherosklerotischer Debris
Embolisches Potential
Zahlreiche Krankheitszustände können zu kardialen Embolien führen und können in Bezug auf ihr embolisches Potential verschieden eingestuft werden. Krankheiten mit hohem Emboliepotential haben ein hohes Risiko einer Embolisation und umgekehrt. In Tabelle 1 sind diese Erkrankungen aufgeführt.
| TABELLE 1. QUELLEN FÜR KARDIALE EMBOLIEN UND EMBOLISCHES POTENTIAL |
| HOHES EMBOLISCHES POTENTIAL |
| Vorhofarrhythmien — insbesondere Vorhofflimmern und Vorhofflattern |
| Ischämische Herzkrankheit – Sowohl die akute als auch die chronische ischämische Herzkrankheit (einschließlich Komplikationen) kann zu Embolien führen |
| Linksventrikuläres Aneurysma mit Thrombus |
| Kardiomyopathien |
| Klappenprothesen |
| Implantate (Herzschrittmacher, ICD, CRT) |
| Endokarditis |
| Herztumore |
| Atherosklerose der Aorta |
| NIEDRIGES EMBOLISCHES POTENTIAL |
| SEP (Spontanes echokardiographisches Potential) |
| Linksventrikuläres Aneurysma ohne Thrombus |
| Mitralklappenprolaps |
| Aortenklappenstenose mit Verkalkung |
| Mitralklappen-Erkrankungen mit Verkalkung |
| Fibrin-Stränge |
| Lambl’sche Exkreszenz |
| Septumdefekte – PFO, ASA, ASD |
Echokardiographie zur Untersuchung kardialer Emboliequellen
Das Ziel der Echokardiographie ist es zum einen zu untersuchen, ob es mögliche Emboliequellen im Herzen gibt, und zum anderen – wenn der Patient einen Schlaganfall erlitten hat – zu beurteilen, ob diese embolische Quelle die wahrscheinlichste Ursache des Ereignisses ist. Die echokardiographische Beurteilung kardialer Emboliequellen erfordert eine sorgfältige bildgebende Untersuchung und Kenntnisse über Differentialdiagnosen. Die Echokardiographie wird typischerweise mit zweidimensionalem (2D) Ultraschall durchgeführt, aber dem 3D-Ultraschall wird in diesem Zusammenhang eine immer größer werdende Rolle zuteil. Bei Verdacht auf einen Thrombus in der Ventrikelhöhle kann Kontrastmittel zur Verbesserung der Bildauflösung gegeben werden.
Die transthorakale Echokardiographie (TTE) liefert sehr häufig ein adäquates Bild der Ventrikel. Die TTE bietet jedoch keine zufriedenstellende Auflösung bei den Vorhöfen, dem Herzohr, dem Vorhofseptum und der Aorta. Wenn der Verdacht besteht, dass die embolische Quelle in einem dieser Orte lokalisiert ist, muss die TEE (transösophageale Echokardiographie) gewählt werden. Mit der TEE wird ein deutlich besseres Bild von Vorhöfen und Aorta erzielt. Im Allgemeinen hat die TEE eine höhere Sensitivität und Spezifität für alle embolischen Quellen mit Ausnahme apikaler Thromben des linken Ventrikels, welche mit der TTE am besten zu sehen sind.
Die TEE sollte bei Verdacht auf einen posterior gelegenen Embolus (linker Vorhof, SEC [spontaneous echo contrast], Aortenplaques, Klappenprothesen, Vegetationen, Defekte des interatrialen Septums, Tumore) bevorzugt werden. Die TTE wird bei Verdacht auf einen Thrombus im linken Ventrikel bevorzugt.
Thromboembolien aus dem linken Herzohr
Der linke Vorhof und das linke Herzohr sind die häufigsten Entstehungsorte kardialer Embolien. Die Thrombusbildung ist stark mit Vorhofarrhythmien (Vorhofflimmern, Vorhofflattern) assoziiert. Die überwiegende Mehrheit der Thromben entsteht im linken Herzohr. Es wird angenommen, dass ein langsamer Blutfluss im Herzohr die Thrombose verursacht (Stase fördert die Koagulation). Ungefähr 75% aller kardialer Embolien stammen aus dem linken Herzohr und dieser Ort sollte bei Patienten mit Vorhofflimmern primär im Verdacht sehen (2).
Morphologie des linken Herzohrs
Es wird davon ausgegangen, dass es mindestens vier verschiedene morphologische Varianten des linken Herzohrs gibt. Di Biase und Kollegen untersuchten verschiedene anatomische Varianten, ihre Prävalenz sowie die Korrelation mit dem Risiko für Schlaganfälle und TIA (3, 4). In der Studie waren 30% wie ein Kaktus, 48% wie ein Hühnerflügel, 19% wie ein Windsack und 3% wie ein Blumenkohl geformt. Die Hühnerflügel-Morphologie war mit dem niedrigsten Risiko für Schlaganfall/TIA assoziiert (79% weniger wahrscheinlich eine Schlaganfall/TIA-Anamnese zu haben).
Vorhofflimmern und kardiale Embolien
Auch wenn wir heute wissen, dass 75% aller kardialer Embolien ihren Ursprung im linken Herzohr haben und die meisten während Episoden von Vorhofflimmern entstehen, sind die genauen Mechanismen der Thrombose weitgehend unbekannt. Laut Virchows Triade gibt es drei Faktoren, die eine Thrombose verursachen:
- Hämodynamische Veränderungen (Stase, Turbulenzen)
- Endothelschäden oder Endotheldysfunktion – Beschädigtes Endothel exponiert Kollagen, was zu einer Reaktion zwischen Kollagen und dem von-Willebrand-Faktor im Blut und folglich zu einer Thrombozytenaktivierung führt
- Hyperkoagulabilität – alle gerinnungsfördernde Zustände, Erkrankungen und Substanzen
Eine Stase des Blutflusses tritt häufig im linken Vorhof und im linken Herzohr auf. Eine milde Form der Stase ist der SEC (engl. spontaneous echo contrast, also spontaner Echokontrast). Dieser wird typischerweise in der TEE und seltener in der TTE visualisiert. Ein SEC tritt auf, wenn der Blutfluss im Vorhof langsamer als normal wird, sodass Erythrozyten aneinander haften und Rouleaux-Aggregate bilden. SEC sieht auf dem 2D-Echobild wie Rauch (engl. smoke) aus und ist bei Vorhofflimmer-Episoden sehr häufig.
Vorhofflimmern führt zu einer Verringerung der effektiven kontraktilen Funktion des Vorhofs, was die wichtigste Erklärung für die Stase des Blutflusses während dieser Episoden ist. Eine Stase kann jedoch auch bei Sinusrhythmus auftreten, wenn der linke Vorhof vergrößert ist. Dies kann z.B. sekundär bei Herzklappenerkrankungen wie der Mitralklappenstenose geschehen.
Wenn der Blutfluss weiter abnimmt, wandelt sich der SEC in sogenannten sludge (Schlamm) um, was bedeutet, dass der Rauch sehr dicht ist.
Der SEC wird im Ultraschallbild als smoke (Rauch) definiert. Sludge ist definiert als dichter smoke. Ein Thrombus ist eine abgrenzbare Masse.
Embolien und elektrische Kardioversion
Bei Patienten mit permanentem Vorhofflimmern sollte keine elektrische Kardioversion durchgeführt werden, da es schnell zu einem Rezidiv kommt. Bei Patienten mit paroxysmalem Vorhofflimmern kann eine elektrische Kardioversion versucht werden. Jede Kardioversion birgt ein Risiko einer Embolisation. Es gibt zwei mögliche Mechanismen, die das Auftreten embolischer Ereignisse nach der Kardioversion erklären könnten:
- Die Embolisation tritt auf, wenn der Sinusrhythmus wiederhergestellt wird und die atriale Kontraktilität zurückkehrt. Die Kontraktionen führen zur Ablösung eines zuvor gebildeten Thrombus.
- Eine Kardioversion könnte zu atrialem stunning (Schock, Betäubung) führen, erkennbar an einem erhöhten SEC nach der Kardioversion. Das stunning führt zu einer Stase und Thrombusbildung nach der Kardioversion (Black et al, Grimm et al).
Die aktuellen Leitlinien (AHA, ESC 2019-2020) legen nahe, dass die Arrhythmiedauer und der CHADS-VASC-Score die Hauptprädiktoren für eine kardiale Embolie nach Kardioversion sind. In Bezug auf die Dauer von Arrhythmien wird Folgendes angenommen: Je länger das Vorhofflimmern anhält, desto größer ist die Wahrscheinlichkeit für die Bildung von Vorhofthromben.
Die meisten Richtlinien haben empfohlen, dass ein Patient bei einer Arrhythmiedauer <48 Stunden subakut kardiovertiert werden kann (d.h. zeitgleich mit dem Beginn einer Antikoagulation mit neuen Antikoagulantien (NOAKs/DOAKs) oder Vitamin-K-Antagonisten). Wenn die Arrhythmie >48 Stunden angehalten hat, sollte die Antikoagulation begonnen und 3-4 Wochen lang fortgesetzt werden, bevor eine Kardioversion versucht wird. Der Zweck einer antikoagulativen Therapie von 3-4 Wochen besteht darin, mögliche Thromben im Vorhof aufzulösen, bevor eine Kardioversion versucht wird. Wenn die Dauer der Arrhythmie unsicher ist oder wenn die Kardioversion frühzeitig durchgeführt werden muss, kann eine TEE (transösophageale Echokardiographie) durchgeführt werden, um Vorhof und Herzohr auf das Vorhandensein von Thromben zu untersuchen (Airaxsinen et al, Alastair et al, Kirchoff, etc.). Es wird davon ausgegangen, dass eine negative TEE-Untersuchung das Vorhandensein von Thromben im linken Vorhof und im linken Herzohr ausschließt, sodass bei negativem TEE-Befund eine Kardioversion unabhängig von der Dauer der Arrhythmie durchgeführt werden kann.
Es ist anzumerken, dass der 48-Stunden-Schwellenwert nicht auf robusten klinischen Daten basiert. Je länger die Dauer der Arrhythmie ist, desto größer ist das Risiko einer kardialen Embolie.
Echokardiographische Beurteilung des linken Herzohrs
Bei der Beurteilung des linken Vorhofs und des Herzohrs sollte überprüft werden, ob der Vorhof vergrößert ist. Dies kann durch Messung des Vorhofdurchmessers (anteroposteriorer Durchmesser) oder einer Schätzung des Vorhofvolumens (kann an die Körperoberfläche justiert werden) erfolgen. Die TEE sollte die bevorzugte Methode für diese Messungen sein. Diese hat im Vergleich zur TTE auch eine signifikant höhere Sensitivität und Spezifität für atriale Thromben. Wie bereits erwähnt kann die TEE verwendet werden, um Vorhofthromben vor der Kardioversion bei Patienten mit Vorhofflimmern/-flattern auszuschließen. In ausgewählten Fällen kann die Untersuchung durch Kontrastmittel oder ein dreidimensionales (3D) TEE erweitert werden.
Thromboembolien aus dem linken Ventrikel
Akuter Myokardinfarkt
Praktisch alle Myokardinfarkte betreffen den linken Ventrikel. Die Begriffe anteriorer, lateraler, septaler und inferiorer Infarkt beziehen sich auf die vier Wände des linken Ventrikels. Der rechte Ventrikel ist in den meisten Fällen nicht betroffen. Ein rechtsventrikulärer Infarkt tritt nur auf, wenn sich die Okklusion im proximalen Segment der rechten Koronararterie (RCA) befindet oder der Ramus marginalis dexter betroffen ist.

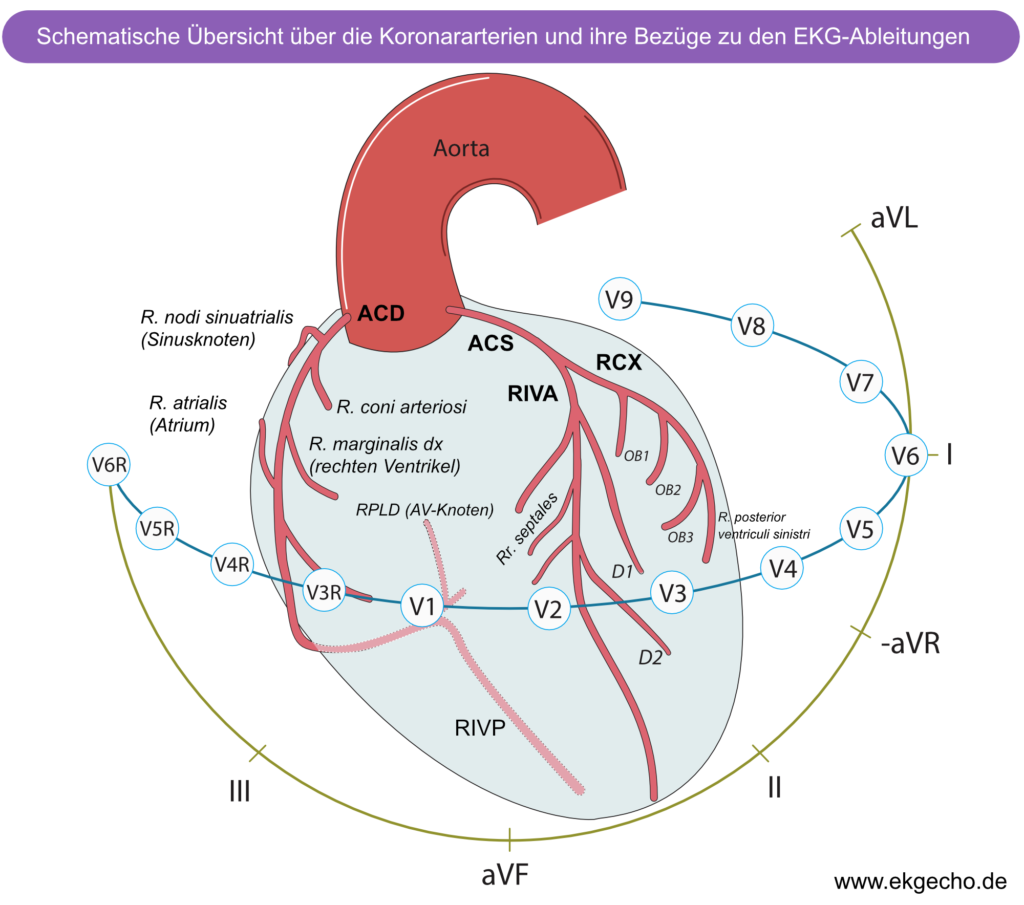
Empfohlenes Kapitel: Lokalisierung eines akuten Myokardinfarkt mittels EKG.
Die Kontraktilität lässt bei einem Myokardinfarkt dauerhaft nach. Abhängig vom Ausmaß des Infarkts weist die betroffene Wand unterschiedliche Grade von Wandbewegungsstörungen auf. Aufgrund der Bewegungsstörungen ist die Geschwindigkeit des Blutflusses über dem betroffenen Bereich reduziert. Gleichzeitig liegt eine Gewebeschädigung und ein möglicherweise pro-thrombogener Zustand vor. Alle diese Faktoren tragen zu einer erhöhten Thrombusbildung bei. Thromben bilden sich typischerweise innerhalb von 24 Stunden nach Beginn des Myokardinfarkts; 90% aller Thromben bilden sich innerhalb von 10 Tagen. Das Risiko einer Thrombusbildung im linken Ventrikel ist besonders groß beim Vorliegen eines linksventrikulären Aneurysmas oder einer linksventrikulären Dilatation. Bis zu 50% aller Fälle von linksventrikulären Aneurysma weisen Thromben auf. Bei Patienten mit akuten Koronarsyndromen haben 5 -15% linksventrikuläre Thromben (Chiarella et al, Solheim et al, Weinsaft et al).
Risikofaktoren für eine linksventrikuläre Thrombose:
Linksventrikuläre Dilatation
Akuter anteriorer Myokardinfarkt
Großer akuter Myokardinfarkt
Reduzierte Ejektionsfraktion
SEC (spontaner Echokontrast) in der Ventrikelhöhle
Kardiomyopathie
Alle Patienten mit Kardiomyopathie haben ein erhöhtes Risiko für eine linksventrikuläre Thrombose. Das Risiko ist am größten, wenn der linke Ventrikel dilatiert ist.
Arten von Thromben im linken Ventrikel
- Wandthromben: Ein Wandthrombus ist eine flache Masse, die sich entlang des Myokards streckt. Diese Thromben weisen das geringste Risiko einer Embolisation auf
- Vorstehende (engl. prolapsing) Thromben: Ein vorstehender Thrombus ragt in die Ventrikelhöhle
- Mobile (engl. mobile) Thromben: Ein mobiler Thrombus ragt in die Ventrikelhöhle und schwingt hin und her. Diese Thromben weisen das größte Risiko einer Embolisation auf
Echokardiographie zur Visualisierung von Thromben im linken Ventrikel
Die transthorakale Echokardiographie (TTE) eignet sich hervorragend zum Nachweis von Thromben im linken Ventrikel. Die TTE hat eine Sensitivität von 95% und eine Spezifität von 85 -90%. Der Thrombus sollte in mindestens zwei verschiedenen Schnittebenen visualisiert werden und erscheint als Masse, die sich an der Endokardoberfläche mit oder ohne hervorstehenden Teil befindet. Das Myokard weist typischerweise Wandbewegungsstörungen auf.
Kardiale Embolien bei Herzklappenerkrankungen
Native und prothetische Klappen können embolische Ereignisse durch Thrombusbildung, Ablösung von Vegetationen (Endokarditis) oder Kalzifizierungen verursachen.
Septische Endokarditis
Endokarditis ist eine häufige Ursache einer kardialen Embolie. Mikroembolien können auch ohne sichtbare Vegetationen auftreten. Je größer die Vegetation, desto größer sind die Embolus-Fragmente (Thuny et al).
Aseptische Endokarditis
Libman-Sacks-Endokarditis (verruköse Endokarditis)
Die Libman-Sacks-Endokarditis ähnelt der bakteriellen Endokarditis in der Echokardiographie. Diese Endokarditis ist jedoch aseptisch (nicht-bakteriell) und die Vegetation besteht aus Immunzellen, Hämatoxylin-Körpern, Gerinnungsfaktoren und Thrombozyten. Die Libman-Sacks-Endokarditis führt nicht zur Zerstörung der Klappe und ist daher weniger akut als die bakterielle Endokarditis. Die meisten Patienten mit Libman-Sacks-Endokarditis weisen milde Symptome auf, was an den geringen hämodynamischen Auswirkungen dieser Endokarditis liegt. Die überwiegende Mehrheit der Patienten, die eine Libman-Sacks-Endokarditis entwickeln, haben einen systemischen Lupus erythematodes. Das Antiphospholipid-Syndrom ist ebenfalls mit der Libman-Sacks-Endokarditis assoziiert.
Die Libman-Sacks-Endokarditis betrifft typischerweise die Mitral- und/oder Aortenklappe. Es ist schwierig, die Libman-Sacks-Endokarditis von einer bakteriellen Endokarditis zu unterscheiden. Darüber hinaus können diese nicht-bakteriellen Vegetationen von Bakterien besiedelt werden und somit in eine bakteriellen Endokarditis übergehen.
Eine Embolisation ist bei der Libman-Sacks-Endokarditis selten.
Marantische Endokarditis
Der Begriff marantisch leitet sich von der Krankheit Marasmus ab, eine Erkrankung, die durch schwere Mangelernährung (hauptsächlich durch Proteinmangel) verursacht wird. Marasmus ist selbst in einkommensschwachen Ländern selten geworden. In der westlichen Welt ist die marantische Endokarditis eine paraneoplastische Manifestation von Karzinomen. Die häufigsten zugrunde liegenden Krebsarten sind Lungenkarzinom, Pankreaskarzinom und Magenkarzinom. Diese Krebsarten führen zu hyperkoagulierbarem Blut, was zur Ansammlung von Fibrin und Thrombozyten an den Klappen führt.
Strands & Lambl’sche Exkreszenzen
Strands (Stränge) und Lambl’sche Exkreszenzen (Auswüchse) kommen sehr wahrscheinlich häufig in der Bevölkerung vor. Einige Studien deuten darauf hin, dass bis zu 50% aller Individuen diese Strukturen aufweisen (Roldan et al), bei denen es sich um faserige Stränge handelt, die typischerweise an den Koaptationslinien der Mitralklappe oder der Aortenklappe auftreten. Die Stränge bestehen aus Kollagen, Elastin und einer äußeren Endothelschicht. Sie haben normalerweise einen Durchmesser von 2 mm und sind 3 bis 10 mm lang. An der Mitralklappe befestigte Stränge erscheinen normalerweise im linken Vorhof, und die an der Aortenklappe befestigten Stränge erscheinen typischerweise im linksventrikulären Ausflusstrakt. Strands und Lambl’sche Exkreszenzen an der Pulmonalklappe und Trikuspidalklappe sind selten.
Die transösophageale Echokardiographie (TEE) ist der Goldstandard für die Diagnose von Strands und Lambl’sche Exkreszenzen, obwohl die Methode es nicht erlaubt, Strands von Exkreszenzen zu unterscheiden.
Strands und Lambl’sche Exkreszenzen verursachen selten eine Thromboembolie.
Verkalkung des Mitralannulus
Der Mitralannulus kann verkalken (kalzifizieren). Ein verkalkter Mitralannulus erscheint als dicker und unregelmäßiger Annulus mit hoher Echogenität in der Echokardiographie. Die Verkalkungen sind meistens an jenem Segment am ausgeprägtesten, an dem das posteriore Segel befestigt ist. Verkalkungen sind am besten in der transthorakalen Echokardiographie (TTE) zu beobachten.
Verkalkungen sind mit einem erhöhten Risiko für kardiale Thromboembolien verbunden, was durch folgende Mechanismen erklärt wird:
- Verkalkungen prädisponieren zu einer bakterielle Endokarditis.
- Verkalkungen sind assoziiert mit Atherosklerose der koronaren, zerebralen und weiteren Arterien. Atherosklerotische Plaques können abreißen und somit zu einer Atherothrombose und einem Arterienverschluss führen.
- Verkalkungen können als Nest für eine Thrombusbildung dienen. Thrombotische Fragmente können sich ablösen und embolisieren.
- Verkalkungen sind mit einer atrialen Dilatation und folglich mit Vorhofflimmern verbunden, was wiederum das Risiko einer Thromboembolie erhöht.
Prothetische Klappen
Mechanische Prothesenklappen sind mit einem sehr hohen Risiko für Thromboembolien verbunden, weshalb die Antikoagulation für diese Personen von grundlegender Bedeutung ist. Die jährliche Inzidenz von Thrombosen beträgt 1,0 bis 2,0% bei Personen mit mechanischen Klappenersätzen, wobei das höchste Risiko bei mechanischen Trikuspidal- oder Mitralklappen besteht. In den meisten dieser Fälle tritt die Thrombusbildung in Episoden auf, während denen die Antikoagulation im subtherapeutischen Bereich liegt. Die Inzidenz von Thrombosen liegt für biologischen Klappenersätzen bei etwa 0,5 -1,0%.
Es sollte angemerkt werden, dass eine Thromboembolie an der Pulmonal- und Trikuspidalklappe eine Lungenembolie verursacht, während eine Thromboembolie auf der linken Seite eine Embolie im systemischen Kreislauf verursacht.
Kardiale Tumoren
Primäre Herztumoren haben ihren Ursprung im Herzen. Diese Tumoren sind meist gutartig, weisen jedoch ein hohes Thromboembolierisiko auf. Myxome und papilläre Fibroelastome haben die höchste Prävalenz unter den Herztumoren. Solche Tumore können eine Thromboembolie verursachen, wenn sich Tumorgewebe löst oder wenn sich Thromben darauf bilden.
Myxom
Ungefähr 75% aller Myxome treten im linken Vorhof auf und diese Tumore haben typischerweise einen Stiel, welcher an der Fossa ovalis befestigt ist. Etwa 30% aller Myxome führen zu einer Thromboembolie.
Papilläres Fibroelastom
Das papilläre Fibroelastom (engl. papillary fibroelastoma, PFE) ist mit einem hohen Risiko für Thromboembolien verbunden. Etwa 80% aller papillären Fibroelastome entstehen an den Klappen, hauptsächlich an der Aortenklappe und der Mitralklappe. PFEs an der Aortenklappe sind typischerweise in der Aortenwurzel sichtbar. Die an der Mitralklappe lokalisierten PFEs werden meist im linken Ventrikel gesehen.
Maligne kardiale Tumore
Das Sarkom ist der häufigste maligne kardiale Tumor. Diese Tumore sind am häufigsten auf der rechten Herzseite lokalisiert und haben ein hohes Risiko für eine Lungenembolie.
Embolien aus der Aorta
Die transthorakale Echokardiographie (TTE) und die transösophageale Echokardiographie (TEE) können große Teile der Aorta visualisieren und Quellen für Thromboembolien diagnostizieren. Die überwiegende Mehrheit aller Embolien aus der Aorta stammt von atherosklerotischen Plaques. Solche Plaques (Atherome) befinden sich in der innersten Schicht der Wand, also der Intima (Tunica intima). Die Entstehung von Plaques beginnt während der Jugend und wird durch Risikofaktoren wie Diabetes (Typ 1, Typ 2), Insulinresistenz, Bluthochdruck, Rauchen, Hypercholesterinämie (Dyslipidämie) und genetische Varianten beschleunigt. LDL-Cholesterin spielt eine fundamentale Rolle bei der Entstehung der Atherosklerose (Libby et al., Ference et al.). Die atherosklerotische Plaques besteht aus Lipiden, Immunzellen (Makrophagen, T-Zellen, B-Zellen) und zellulärem Debris. Plaques sind vulnerabel, was bedeutet, dass sie einreißen oder ulzerieren können. Die Plaquelast (die Menge der Atherosklerose) nimmt typischerweise von der proximalen zur distalen Aorta hin zu. Das Risiko einer Embolie korreliert stark mit der Plaquelast. Die folgenden Mechanismen führen zu einer Thromboembolie:
- Thrombose – Ruptur oder Ulzeration eines atherosklerotischen Plaques führt zur Thrombusbildung und Embolie.
- Cholesterinembolie – einige Plaques haben eine sehr hohe Cholesterinkonzentration, die zur Bildung von Kristallen führt. Cholesterinkristalle können sich ablösen und somit eine Embolie verursachen.
Eine Aortenthrombose kann zu großen Embolien führen, die große Arterien verschließen. Schlaganfälle, TIAs, Niereninfarkte, intestinale Ischämien und Extremitätenischämien sind bei Aortenthrombosen häufig.
Eine Cholesterinembolie führt zur Embolisation kleiner Kristalle, die zur Okklusion von distalen (kleineren) Arterien führt. Mehrere Embolie können gleichzeitig auftreten. Häufige Komplikationen sind Nierenversagen, kleinere Hirninfarkte, leichtgradige Extremitätenischämien usw.
Die transthorakale Echokardiographie (TTE) ermöglicht die Visualisierung der Aortenklappe und der Aorta ascendens. Dies reicht nicht aus, um die Plaquelast und das Vorhandensein von Aortenthromben zu bewerten. Die transösophageale Echokardiographie (TEE) ist notwendig, um die Aorta ascendens, den Aortenbogen und die absteigende Aorta zu visualisieren. Die TEE bietet auch eine höhere bildliche Auflösung der Aortenwurzel. Sie erlaubt jedoch nicht die Visualisierung des Aortensegments genau proximal der Arteria brachiocephalica, was darauf zurückzuführen ist, dass dieses Segment durch den rechten Bronchus und die Trachea verdeckt ist. Die TEE ermöglicht in der Regel die Visualisierung der Aorta bis hin zu Arteria mesenterica superior. MRT oder CT können mitunter notwendig sein, um zufriedenstellende Bilder zu erhalten.
Paradoxe Embolien
Eine paradoxe Embolisation bedeutet, dass ein Embolus des venösen Systems im arteriellen System endet und einen Verschluss auf der arteriellen Seite verursacht. Dies kann auftreten, wenn es eine Kommunikation zwischen der rechten und der linken Hälfte des Herzens gibt. Beispiele für solche Verbindungen sind folgende Defekte:
- Persistierendes Foramen ovale (PFO) (Homma et al)
- Vorhofseptumdefekt
Persistierendes Foramen ovale
Das Vorhofseptum besteht aus zwei Strukturen, dem Septum primum und dem Septum secundum. Während des fetalen Lebens sind das Septum primum und das Septum secundum getrennt, was zu einem Kanal führt, der als Keilventil zwischen den Vorhöfen dient. Dieser Kanal ist das Foramen ovale. Während des fetalen Lebens ist das Foramen ovale lebenswichtig, damit das sauerstoffreiche Blut der Plazenta von der Vena cava inferior in den rechten Vorhof und direkt in den linken Vorhof übergeht. Bei der Geburt wird das Foramen ovale sowie das Septum primum verschlossen und das Septum secundum wächst zusammen. Der Verschluss erklärt sich aus der Tatsache, dass der Druck auf der linken Seite nach der Geburt dramatisch ansteigt, wodurch das Keilventil nicht geöffnet werden kann. So kommt es zu einer allmähliche Versiegelung des Septum primums und secundums. Der Zusammenwuchs ist jedoch in 25% unvollständig und in diesen Fällen verbleibt ein Fenster zwischen dem rechten und linken Vorhof. Dieses Fenster nennt man ein persistierendes Foramen ovale (PFO). Da PFO eine Prävalenz von 25% hat, kann es als Normalvariante angesehen werden. Ein PFO wird oft von einem Aneurysma des Septum primum begleitet. Die Öffnung selbst weist eine große Vielfalt auf. Einige PFOs sind sehr groß, während andere kleine Tunnel sind.
Ein PFO hat keine hämodynamische Bedeutung, aber die Verbindung kann dazu führen, dass eine Embolie aus dem rechten Vorhof in den linken Vorhof übertritt. So können Embolien, die sich in den Venen (zum Beispiel in den Beinen) bilden, vom rechten in den linken Vorhof übergehen und Okklusionen im systemischen Kreislauf (auf der arteriellen Seite) hervorrufen. Dies nennt man paradoxe Embolisation.
In Situationen mit erhöhtem Druck auf der rechten Seite zeigen Personen mit PFO ein Shunting, was bedeutet, dass Blut vom rechten in den linken Vorhof fließt. Dies bedeutet, dass beispielweiser bei pulmonaler Hypertonie oder Valsava-Manöver ein Fluss vom rechten zum linken Vorhof beobachtet werden kann.
Atriales Septumaneurysma
Ein atriales Septumaneurysma (engl. atrial septal aneurysm, ASA) bedeutet, dass der Bereich des Septums, welcher der Fossa ovalis entspricht, aus der Mittellinie herausragt. Das Anerusym kann fixiert oder wellig sein. Man geht davon aus, dass ein ASA das Risiko einer paradoxen Embolisation erhöht. Potentiell können große Aneurysmen nämlich der Nährboden für Thrombosen sein, da das Blut im Aneurysma steht.
Kryptogener Schlaganfall
Ein kryptogener Schlaganfall bedeutet, dass man die Ursache des Schlaganfalls nicht feststellen kann. Bei einem kryptogenen Schlaganfall steht eine paradoxe Embolisation häufig im Verdacht. Ein PFO ist häufiger bei Menschen mit kryptogenem Schlaganfall. Bis zu 40% der Patienten mit kryptogenem Schlaganfall haben ein PFO, welches einen dazu verleitet, den Schlaganfall mit einer paradoxer Embolisation zu erklären. Es ist jedoch oft schwierig, mit Sicherheit festzustellen, ob eine paradoxe Embolisation die tatsächliche Ursache ist.
Lungenembolie
Die Lungenembolie ist die dritthäufigste kardiovaskuläre Todesursache nach akutem Myokardinfarkt und Schlaganfall. Etwa 90 -95% aller Lungenembolien stammen aus Venen, insbesondere aus den Beinenvenen. Andere Ursachen einer Lungenembolie sind Endokarditis, tumorassoziierte Thrombosen oder Thrombosen an implantierten Elektroden. Die Mortalität der Lungenembolie beträgt 10%. Sie ist signifikant höher als die Mortalität des STEMI (6 -7%) und NSTEMI (5%). Der zum Tode führende Mechanismus bei der Lungenembolie ist der Kreislaufkollaps als Folge eines Embolus, der den Blutfluss durch den Lungenkreislauf verhindert.
Eine Lungenembolie wird typischerweise im CT diagnostiziert. Die Echokardiographie kann zur Risikostratifizierung eingesetzt werden. In der echokardiographischen Untersuchung sollten folgende Hinweise auf eine Lungenembolie erkannt werden:
- Vorhandensein von Thromben in der Vena cava inferior, in den Lebervenen, im rechten Herz.
- Rechtsventrikuläre Belastung: Echokardiographische Anzeichen einer rechtsventrikulären Belastung sind Dilatation und Dysfunktion des rechten Ventrikels. Die Dilatation ist definiert als dass der rechte Ventrikel mindestens so groß wie der linke Ventrikel ist.
- Paradoxe septale Bewegung, was bedeutet, dass sich das Septum in den linken Ventrikel wölbt.
- Dilatierte proximale Lungenarterien.
- Erhöhter Druck im rechten Ventrikel.
- Abnormale Trikuspidalinsuffizienz (TI).
- Erhöhter Druck im rechten Vorhof (sichtbar als dilatierte Vena cava inferior ohne respiratorischen Kollaps).
- McConnell’s Zeichen: Erhaltene apikale Kontraktilität im rechten Ventrikel, aber beeinträchtigte basale und mitt-ventrikuläre Kontraktilität.
Es gibt keine Ultraschallmethode, die eine Lungenembolie ausschließen kann.
Klassifikation der Lungenembolie
- Massive Lungenembolie: Lungenembolie mit Hypotonie
- Submassive Lungenembolie: Lungenembolie ohne Hypotonie, jedoch mit Anzeichen einer rechtsventrikulären Belastung oder erhöhten kardialen Schädigungsmarkern (erhöhte Troponine)
- Lungenembolie mit geringem Risiko: keins vom oben Genannten
Eine Dilatation des rechten Ventrikels wird auch bei folgenden Erkrankungen beobachtet:
- COPD (chronisch obstruktive Lungenerkrankung)
- Cor pulmonale (z.B. aufgrund von Asthma)
- Pulmonale Hypertonie
- Schlafapnoe
- Rechtsherzinsuffizienz
- Rechtsventrikulärer Myokardinfarkt
Literatur
1. Global, regional, and national age-sex-specific mortality for 282 causes of death in 195 countries and territories, 1980–2017: a systematic analysis for the Global Burden of Disease Study 2017. GBD 2017 Causes of Death Collaborators
2. Saric et al: Guidelines for the Use of Echocardiography in the Evaluation of a Cardiac Source of Embolism. Journal of the American Society of Echocardiography.
3. Di Biase Thrombogenic and Arrhythmogenic Roles of the Left Atrial Appendage in Atrial Fibrillation Clinical Implications. Circulation 2018
4. Di Biase: Does the Left Atrial Appendage Morphology Correlate With the Risk of Stroke in Patients With Atrial Fibrillation? Results From a Multicenter Study. JACC 2012.